
Berdasarkan pada hukum "Raoult" yang dikemukakan oleh Francois Marie Roult, "Sifat koligatif larutan ada 4, yaitu ; penurunan ttekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik."
A. Sifat Koligatif Larutan Nonelektrolit
=> Sifat larutan yang bergantung pada konsentrasi partikel zat terlarutnya, tetapi tidak bergantung pada jenis zat terlarut. Sifat koligatif larutan terdiri dari dua jenis, yaitu sefat koligatif larutan elektrolit dan sifat koligatif larutan nonelektrolit.
Baca juga Sifat koligatif larutan elektrolit
1. Penurunan Tekanan Uap Jenuh (∆P)
∆P = Penurunan Tekanan Uap Jenuh
Po = Penurunan Tekanan Uap Jenuh Pelarut Murni
P = Tekanan Uap Jenuh Larutan
Xp = Fraksi mol Pelarut
Xt = Fraksi mol Zat Terlarut
n = Jumah mol
n = Jumah mol
2. Kenaikan Titik Didih
Titik didih suatu cairan adalah suhu ketika tekanan uap cairan itu sama dengan tekanan luar (tekanan atas cairan tersebut). Nah, kenaikan titik didih adalah selisih antara titik didih larutan dengan titik didih pelarut.Titik didih tergantung pada kepada tempat cairan itu dipanaskan. Cairan yang dipanaskan di daerah pantai akan berbeda dengan cairan yang dipanaskan di daerah pegungan.
Titik didih larutan lebih tinggi dari ttitik didih pelarutnya.
(a). ∆Tb = titik didih larutan - titik didih pelarut
sehingga titik didih larutan = ∆Tb + titik didih pelarut
(b). ∆Tb = m x Kb
keterangan :
∆Tb = kenaikan titik didih larutan
Kb = tetapan kenaikan titik didih molal
m = kemolalan larutan
3. Penurunan Titik Beku (∆Tf)
Titik beku suatu cairan adalah suhu ketika tekanan uap cairan itu sama dengan tekanan uap dalam keadaan padat. Pada pembekuan suatu larutan, yang mengalami pembekuan adalah hanya pelarutnya saja, sedangkan zat terlarut tidak ikut membeku.
ketika kita membuat teh manis kemudia disimpan dalam freezer. Setelah membeku, minumlah es teh manis itu tanpa menghancurkan balok es yang terbentuk. Apa yang terasa? Apakah balok es itu manis?
Adanya zat terlarut mengakibatkan suatu pelarut semakin sulit membeku, akibatnya titik beku larutan akan lebih rendah dibandingkan dengan titik beku pelarut murninya. Selisih antara titik beku larutan dengan titik beku pelarut murninya disebut penurunan titik beku larutan.
(a). ∆Tf = titik beku pelarut - titik beku larutan
sehingga titik beku larutan = titik beku pelarut - ∆Tf (b). ∆Tf = m x Kf
keterangan :
∆Tf = penurunan titik beku larutan
Kf = tetapan penurunan titik beku molal
m = kemolalan larutan
Baca juga Konsentrasi Zat
4. Tekanan Osmotik Larutan (
Tekanan osmotik larutan adalah tekanan yang diperlukan unutk mencegah aliran pelarut ke dalam suatu larutan melalui membran semipermiable. Osmosis adalah peristiwa perpindahan molekuk pelarut dari larutan yang encer ke larutan yang lebih pekat. Membran semipermiable adalah membran yang dapat ditembus oleh molekul pelarut, tetapi tidak dapat ditembus oleh molekul zat pelarut.
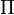 = (n/V) x R x T atau
= (n/V) x R x T atau 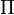 = C R T
= C R T
Keterangan
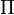 = tekanan Osmotik (atm)
= tekanan Osmotik (atm)
V = Volume larutan (L)
n = Jumlah mol zat terlarut (mol)
R = tetapan gas (0,082 L atm mol -1 K-1
C = molaritas (M)
∆Tf = penurunan titik beku larutan
Kf = tetapan penurunan titik beku molal
m = kemolalan larutan
4. Tekanan Osmotik Larutan (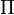 )
)
Tekanan osmotik larutan adalah tekanan yang diperlukan unutk mencegah aliran pelarut ke dalam suatu larutan melalui membran semipermiable. Osmosis adalah peristiwa perpindahan molekuk pelarut dari larutan yang encer ke larutan yang lebih pekat. Membran semipermiable adalah membran yang dapat ditembus oleh molekul pelarut, tetapi tidak dapat ditembus oleh molekul zat pelarut.
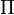 = (n/V) x R x T atau
= (n/V) x R x T atau 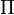 = C R T
= C R TKeterangan
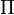 = tekanan Osmotik (atm)
= tekanan Osmotik (atm)V = Volume larutan (L)
n = Jumlah mol zat terlarut (mol)
R = tetapan gas (0,082 L atm mol -1 K-1
C = molaritas (M)
0 komentar:
Post a Comment